Le produit PrAcétate de glatiramère injectable doit être conservé de préférence au réfrigérateur, mais peut être entreposé jusqu’à 1 mois à la température ambiante (de 15 à 30 °C) en l’absence de possibilité de réfrigération.
Veuillez entrer le numéro d’identification du médicament (DIN) à 8 chiffres tel qu’indiqué sur l’étiquette de votre médicament PrAcétate de glatiramère injectable
Qu’est-ce que le produit Acétate de glatiramère injectable?
Acétate de glatiramère injectable est une solution apyrogène stérile et limpide, incolore à jaunâtre, en seringue unidose préremplie de 1 mL avec aiguille fixe de calibre 29 (1,25 cm) fournie comme suit :
20 mg/mL
une fois par jour
En seringue unidose préremplie avec
piston bleu pâle, sous emballage-coque
individuel par boîtes de 30 unités

Cela signifie que le produit Acétate de glatiramère injectable de Viatris peut être substitué à la dose équivalente de COPAXONE et qu’on peut s’attendre à ce qu’il offre un profil d’innocuité et d’efficacité comparable1.
Tout comme COPAXONE, Acétate de glatiramère injectable de Viatris est disponible sur ordonnance seulement et destiné à l’injection sous-cutanée3.

Un médicament complexe, mais pas un produit biologique
Un produit biologique est une protéine dérivée d’un organisme vivant servant à traiter ou guérir des maladies. Comme les polypeptides qui le composent sont fabriqués en laboratoire, l’acétate de glatiramère n’est pas classé parmi les produits biologiques4.
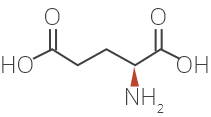
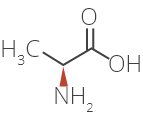
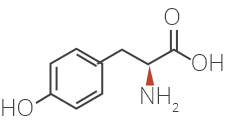
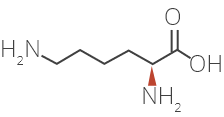
Les modes d’action de l’acétate de glatiramère chez les patients atteints de sclérose en plaques ne sont pas entièrement connus. L’acétate de glatiramère est un mélange de polypeptides synthétiques contenant quatre acides aminés. Nous savons que ce médicament est facilement absorbé par voie sous-cutanée et que la majeure partie de la dose est rapidement dégradée en petits fragments dans l’hypoderme. On présume que l’acétate de glatiramère stimule les cellules régulatrices qui inhibent le processus lésionnel immunitaire caractéristique de la SP.

IMPORTANT SAFETY INFORMATION
Indications et usage clinique
Le produit Acétate de glatiramère injectable (acétate de glatiramère) à 20 mg/mL une fois par jour est indiqué pour :
- Le traitement des patients ambulatoires atteints de sclérose en plaques (SP) rémittente, y compris ceux qui ont subi un
événement démyélinisant unique et qui ont des lésions typiques de la SP détectées par examens d’imagerie par résonance
magnétique (IRM) cérébrale :
- Pour diminuer la fréquence des poussées cliniques.
- Pour réduire le nombre et le volume des lésions cérébrales actives détectées par examens d’IRM.
L’innocuité et l’efficacité dans la SP chronique progressive n’ont pas été évaluées.
Contre-indications
- Hypersensibilité à ce médicament ou à l’un des ingrédients de la formulation de ce dernier, y compris à un des ingrédients non médicinaux, ou à un composant du contenant.
Mises en garde et précautions les plus importantes
Voie d’administration : La seule voie d’administration recommandée est la voie sous-cutanée; ne doit pas être administré par voie intraveineuse ou intramusculaire.
Généralités : Les patients doivent apprendre les techniques d’autoinjection respectant l’asepsie pour que l’administration s’effectue de façon sûre, ce qui comprend la lecture de la PARTIE III : Renseignements sur le médicament pour le patient. La première injection doit être effectuée sous la supervision d’un professionnel de la santé qualifié. Il convient de vérifier périodiquement si les patients comprennent et respectent les techniques aseptiques d’autoinjection. On doit avertir les patients de ne pas réutiliser les aiguilles, les seringues ou les stylos et leur expliquer les procédures de mise au rebut appropriées. Les patients doivent jeter les aiguilles, les seringues et les stylos utilisés dans un contenant non perforable. On doit leur expliquer comment mettre au rebut les contenants non perforables une fois remplis.
Effets indésirables localisés associés à l’administration sous-cutanée : Des cas de lipoatrophie localisée et de rares cas de nécrose cutanée au point d’injection ont été rapportés. La lipoatrophie peut se manifester après le début du traitement (quelquefois dès les premiers mois) et être permanente. Pour contribuer à réduire au minimum ces effets, il faut aviser le patient de suivre une bonne technique d’injection et de faire régulièrement la rotation des zones et des points d’injection.
Appareil cardiovasculaire : Symptômes qui risquent d’avoir une origine cardiaque, douleur thoracique transitoire; réaction immédiate suivant l’injection, comprenant au moins deux des symptômes suivants : bouffées congestives, douleur thoracique, palpitations, anxiété, dyspnée, constriction de la gorge et urticaire.
Fonction hépatique : De très rares cas de lésions hépatiques graves (dont l’insuffisance hépatique et l’hépatite avec ictère) et
des cas rarissimes d’hépatite fulminante nécessitant une transplantation hépatique ont été signalés chez des patients ayant
ou non des facteurs de risque pertinents dans leurs antécédents médicaux, quelques jours à plusieurs années après le début du
traitement. Certains cas évoquaient une hépatite
Système immunitaire : Considérations en matière d’utilisation d’un produit capable de modifier les réactions immunitaires, substance antigénique dont l’utilisation risque de déterminer des réactions délétères pour l’hôte. On ignore si le produit peut modifier les réactions immunitaires normales de l’être humain, comme la reconnaissance des antigènes étrangers. Il est donc possible que le traitement puisse altérer les mécanismes de défense de l’organisme contre les infections ainsi que les mécanismes de surveillance des tumeurs. L’altération continue de l’immunité cellulaire due au traitement chronique pourrait entraîner des effets indésirables. Étant donné que l’anaphylaxie peut être associée à l’administration de presque toutes les substances étrangères, ce risque ne peut être exclu. Il convient de faire preuve de prudence chez les patients présentant des antécédents de réactions anaphylactoïdes graves, de maladie pulmonaire obstructive ou d’asthme, et chez des patients qui reçoivent des médicaments pour le traitement de l’une de ces deux dernières affections.
Surveillance et épreuves de laboratoire : Il convient de surveiller la fonction rénale des patients atteints d’insuffisance rénale durant le traitement; les transaminases hépatiques doivent être vérifiées dans les 6 mois précédant le début du traitement et pendant le traitement, si la situation clinique le justifie.
Grossesse : Doit être administré pendant la grossesse uniquement si, selon le jugement du médecin, les avantages potentiels l’emportent sur les dangers possibles.
Allaitement : La prudence est de mise lors de l’administration à une femme qui allaite.
Autres mises en garde et précautions pertinentes
- Réaction suivant l’injection : bouffées congestives, étourdissements, éruption cutanée accompagnée d’une irritation, transpiration abondante, douleur thoracique, constriction au niveau de la poitrine, battements cardiaques irréguliers, anxiété, difficulté à respirer, constriction au niveau de la gorge, urticaire apparaissant immédiatement après l’injection
- Hypotension : étourdissements, fatigue, nausées
- Hypertension : maux de tête, étourdissements, vision trouble ou essoufflement
- Difficultés respiratoires : essoufflement, difficulté à respirer
- Battements cardiaques : battements cardiaques rapides ou irréguliers
- Douleur : pression ou constriction au niveau de la poitrine, du dos, du cou ou des articulations
- Angioœdème : enflure des bras, des jambes ou de la face
- Dépression : modification du poids, difficulté à dormir et manque d’intérêt pour les activités habituelles
- Vision : changements de la vision
Pour de plus amples renseignements :
Consultez la monographie du produit à https://produits-sante.canada.ca/dpd-bdpp/index-fra.jsp pour obtenir de plus amples renseignements sur les conditions d’usage clinique, les contre-indications, les mises en garde, les précautions, les réactions indésirables, les interactions et la posologie. Vous pouvez également obtenir la monographie du produit en appelant au 1 844 596-9526.